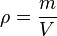Presentación:
A continuación se vera una polémica conocida entre científicos por el agua.
Propósito:
Conocer y comprobar si el agua es un compuesto o un elemento por medio de la hidrólisis.
Base Teórica:
El agua esta compuesta por 2 moléculas es deir es un compuesto, ya que está formado por dos o más átomos que están unidos por enlaces químicos. No es una mezcla porque estas entidades no tienen interacciones químicas entre los componentes, solo físicas. También sabíamos que los elementos que componen el H2O tienen propiedades diferentes es decir el Hidrógeno es un conbuerente y es explosivo y el Oxigeno es un combustible.
Hipótesis:
Todo el grupo pensó que era una mezcla.
Variables:
Su estado físico.
Experimentación.
Materiales:
-2 tubos de ensayo
-agua
-H2O2
-Mno
-Zn
-Hcl
Empezamos haciendo las reacciones químicas y obtuvimos Hidrógeno en estado gaseoso y Oxigeno en el mismo estado y comprobamos sus propiedades después separamos el agua con el aparato de Hoffman y se separo uno en el electrón + (carga positiva) y el otro en el -(carga negativa)
Concluciones:
Por el proceso de electrólicis comprobamos que el agua es un compuesto ya que esta formada por dos elementos que son el O2 y H2 y cada uno de ellos adquiere propiedades diferentes a juntárlos y al separarlos y el H2 hiso una pequeña exploción y el Oxigeno ibivo la flama cuando realizamos la Hidrólisis en la carga -(negativa) se formo el hidrógeno y en +(positiva) el oxigeno.
Química Vallejo 186
martes, 4 de diciembre de 2012
Ph del Agua
Presentación:
A continuación se mostrar otra propiedad del agua.
c
Propósito:
conocer el nivel de acidez del agua por medio del ph.
Base Teórica:
A continuación se mostrar otra propiedad del agua.
c
Propósito:
conocer el nivel de acidez del agua por medio del ph.
Base Teórica:
pH
. El pH (potencial de hidrógeno) es una medida de acidez o alcalinidad de una disolución. El pH indica la concentración de iones hidrónio [H 3 O + ] presentes en determinadas sustancias .
La escala de pH por lo regular va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 y alcalinas las que tienen pH mayores a 7 cuando el pH es =7 indica la neutralidad de la disolución (cuando el disolvente es agua)
Referencia: “pH neutro” (en español) págs. 2 y 3. México investigación realizada por la dirección Médica de Esteripharma. (11 de julio de 2011)
Hipótesis:
Se creyó que el agua no era ácida, debido a que si fuera así no sería una substancia bebible.
Variable:
Fue un poco la cantidad de sustancia y la de indicador universal.
Experimentación.
Materiales:
-Indicador Universal
-Agua(de la llave)
-Agua(destilada)
-6 tubos de ensayo
-NaOH
-Hcl
Primero se clasificaron los 5 tubos llamados testigos, blanco y problema que en este caso era el agua, después fui llenando los seis tubos de ensayo con los compuestos antes mencionados. Después agregué unas gotas de indicador universal y los agité. Al agitar poco a poco la substancias cambiaban de color y así obtuve los resultados
Tabla de Resultados.
Conclusión:
Al realizar la prueba 6 veces se dio a conocer que el agua es neutra, por su color verde.
Densidad del Agua
Este experimento nos mostrara otra propiedad de la "sustancia de la vida", el agua.
Propósito: conocer la densidad que tiene el agua.
Base Teórica:

Propósito: conocer la densidad que tiene el agua.
Base Teórica:
En física y química, la densidad (símbolo ρ) es una magnitud escalar referida a la cantidad de masa contenida en un determinado volumen de una sustancia. La densidad media es la razón entre la masa de un cuerpo y el volumen que ocupa
La densidad del agua es muy usada como patrón de densidades y volúmenes de otras sustancias y/o compuestos.
Una propiedad importante de la densidad del agua es que es muy estable, ya que esta varía muy poco a los cambios de presión y temperatura.
En esta tabla presentamos las densidades del agua a diferentes temperaturas, expresados en Kg/m3
The First Eureka Moment, ciencia 305: 1219, agosto 2004
Hipótesis:
Pensé que la densidad que tiene el agua es baja y que sin importar la temperatura seguiría igual.
Variables: temperatura, presión.
Experimentación.
Materiales:
-Probeta
-Balanza
-Vaso de precipitados
-Agua
Empecé pesando el baso de precipitados solo para que no afectara la medición de la masa del agua que recordé que casi igual que la masa de un cuerpo y fui llenando la probeta para tener un volumen exacto y no alterar las mediciones esto lo hice con varios volúmenes para obtener mejore datos.
Tabla de resultados.

Conclusión: viendo de los equipos de mis compañeros pude observar que la densidad del agua promedio es más baja de lo que se mostraba en la base teórica.
Punto de Ebullición
Presentación:
Con fin de este experimento podremos ver la ebullición del agua.
Propósito:
Entender y conocer una propiedad diferente del agua.
Base Teórica:
La ebullición es el proceso físico en el que la materia pasa a estado gaseoso. Se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión. Si se continúa calentando el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión de la materia en estado líquido al estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura de la materia, ya como gas. Este proceso es muy distinto a la evaporación, que es paulatino y para el que, en altitudes superiores, la presión atmosférica media disminuye, por lo que el líquido necesita temperaturas menores para entrar en ebullición. En una olla a presión, el agua, por ejemplo, llega a una temperatura de 120 o 130 °C antes de hervir, debido a la mayor presión alcanzada por los gases en su interior.
Referencias: Química. Problemas y ejercicios de aplicación para Química Autor: Coba,Yael Editorial: Eudeba Edición: 1º-2010 ISBN : 978-950-23-1702-1 página 27.

Con fin de este experimento podremos ver la ebullición del agua.
Propósito:
Entender y conocer una propiedad diferente del agua.
Base Teórica:
La ebullición es el proceso físico en el que la materia pasa a estado gaseoso. Se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión. Si se continúa calentando el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión de la materia en estado líquido al estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura de la materia, ya como gas. Este proceso es muy distinto a la evaporación, que es paulatino y para el que, en altitudes superiores, la presión atmosférica media disminuye, por lo que el líquido necesita temperaturas menores para entrar en ebullición. En una olla a presión, el agua, por ejemplo, llega a una temperatura de 120 o 130 °C antes de hervir, debido a la mayor presión alcanzada por los gases en su interior.
Referencias: Química. Problemas y ejercicios de aplicación para Química Autor: Coba,Yael Editorial: Eudeba Edición: 1º-2010 ISBN : 978-950-23-1702-1 página 27.
Hipótesis:
La mayoría del grupo planteo que la ebullición del agua era de 100 grados Variables.
Materiales:
-mechero
-termometro
-soporte universal
-agua
-vaso de precipitado
Comenzamos hirviendo el agua y al pasar el tiempo su temperatura incremento hasta un punto donde no pudo subir más.
Resultado:

Conclusión: en la tabla se muestra el punto de ebullición del agua que sería de 94° es decir la presión atmosférica rica y que no subió mas de esa temperatura en barios minutos.
Presentación
Hola mi nombre es Jesús Contreras López, estoy comprometido con el recursamiento de química 1 estoy dispuesto a hacer todas las practicas que se tengan que hacer, trabajos, tareas, etc.
En este blog se pretende mostrar todos los experimentos que se llevarán acabo durante el curso de química 1 del grupo 186
En este blog se pretende mostrar todos los experimentos que se llevarán acabo durante el curso de química 1 del grupo 186
Suscribirse a:
Entradas (Atom)